Questo non è un altro articolo sull’integrità dei dati, ma si tratta di dimostrare ai revisori che avete tutto sotto controllo.
Abbiamo tutti partecipato ai mille corsi di formazione, agli webinar ed alle presentazioni sulle raccomandazioni e le linee guida sull’integrità dei dati. Conosciamo a memoria la definizione di ALCOA e leggiamo diverse lettere 483 piuttosto terrificanti.
Probabilmente siete stati anche coinvolti in un progetto specifico di Data Integrity nella vostra azienda o semplicemente vi è stato chiesto di partecipare a una serie di corsi di formazione interni per aumentare la consapevolezza sugli impatti delle vostre azioni dal punto di vista dell’integrità dei dati. Le politiche aziendali vengono rinforzate con simpatici poster che sono probabilmente in bella mostra nei corridoi della vostra società.
L’integrità dei vostri dati lungo il loro ciclo di vita
Oltre al fattore umano che viene affrontato rafforzando le regole di etica aziendale, l’integrità dei vostri dati è questione di una gestione adeguata del ciclo di vita dei dati aziendali e dei suoi molteplici flussi di lavoro.
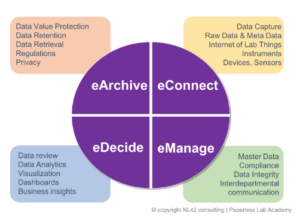
Noi di NL42 siamo noti per la Paperless Lab Academy dove rinforziamo il concetto che nessun progetto di trasformazione digitale può prescindere da una chiara comprensione del vostro ciclo di vita dei dati, che organizziamo in 4 fasi principali quando parliamo di dati elettronici o eData, dove ci concentriamo sull’acquisizione iniziale dei dati grezzi – eConnect, sulla gestione corretta e conforme – eManage, sul facile accesso ai dati per un valido processo decisionale – eDecide e l’utilizzo dei principi FAIR (Findable, Accessible, Interoperable e Reusable) – eArchive.
Quando si indaga su possibili violazioni dell’integrità dei dati, gli auditor alla fine si limitano a usare il buon senso e ad applicare una logica implacabile sul “COME” vengono gestiti i vostri dati. Essi tenderanno sempre più a preferire l’implementazione di soluzioni digitali, con le capacità della CFR21/11 abilitate e le corrette definizioni di accesso degli utenti. Anche se tutte le possibili interazioni umane suscettibili di errori di trascrizione vengono eliminate, ci sono ancora due grandi preoccupazioni su cui gli auditor si concentreranno.
Accesso ai dati grezzi originali e ai loro metadati
Il passo di eConnect sta diventando di importanza cruciale in quanto l’attenzione degli auditor si sta spostando verso la strumentazione di laboratorio e le capacità di fornire i loro dati in uscita in formato elettronico. I dati grezzi e i metadati corrispondenti devono essere accessibili per poter verificare facilmente non solo il risultato finale, ma anche l’intera elaborazione dei dati.
Inoltre, oltre alla possibilità di rivedere l’elaborazione dei dati, tutte le informazioni relative ai record di controllo della qualità, alle eccezioni e alla rivalutazione dovrebbero essere perfettamente accessibili in qualsiasi momento.
Curiosamente negli ultimi 10 anni, anche se i sistemi di gestione delle informazioni di laboratorio hanno notevolmente migliorato le loro capacità di interconnessione con gli strumenti di laboratorio, l’integrazione degli strumenti tende a cadere sempre in una fase 2 di implementazione e la maggior parte delle volte non viene implementata affatto.
Valutazione del fornitore, documentazione e convalida dei sistemi informatici
Valutare il sistema di qualità del fornitore che sviluppa i software, documentare fin dal primo momento della pianificazione del progetto per facilitare le fasi di convalida è ancora una volta una forte raccomandazione da parte nostra.
Purtroppo, di recente, l’EMA ha dovuto rafforzare ulteriormente questo aspetto. Nell’aprile 2020, l’EMA ha pubblicato un “Avviso agli sponsor sulla convalida e la qualificazione dei sistemi computerizzati utilizzati negli studi clinici” che potrebbe essere facilmente esteso a qualsiasi flusso di lavoro di gestione dei dati scientifici non ancora sufficientemente maturato per quanto riguarda la gestione dell’integrità dei dati.
L’integrità dei vostri processi senza carta si basa sulla comprensione approfondita del vostro ciclo di vita dei dati e su una documentazione precisa per qualificare le funzionalità e convalidare l’affidabilità e la robustezza del vostro sistema computerizzato nella gestione dei vostri dati. La mancata documentazione e quindi la mancata dimostrazione dello stato convalidato di un sistema informatico può rappresentare un rischio.
Noi possiamo aiutarvi! Vorremmo aiutarvi ad assicurare che il vostro investimento in tempo e denaro sia pienamente conforme e vi protegga da qualsiasi rischio potenziale.
Contattateci ora! Ricominciamo insieme!