Da un recente articolo di Ympronta: “In che modo la FDA aiuta le aziende farmaceutiche ad essere sempre conformi alle proprie normative”.
Le linee guida ufficiali sull’integrità dei dati sono in pieno vigore ormai da più di 5 anni. Non c’è professionista del settore Life Sciences che non abbia mai sentito parlare di Data Integrity. All’inizio questo termine faceva paura. Tuttavia, le aziende che rispettano le current Good Manufacturing Practices (cGMP) hanno capito che non hanno nulla di cui preoccuparsi. E lo possiamo intuire anche dal titolo del documento ufficiale della FDA: “Data Integrity and Compliance With Drug CGMP”.
Ma quindi, se le nuove linee guida sono entrate in vigore mentre le vecchie buone GMP sono ancora valide, significa che dobbiamo applicarle entrambe? Dovremmo combinarle con le procedure operative che qualsiasi azienda farmaceutica, che si rispetta, applica già?
I BENEFICI DI GMP
Rispondiamo subito alla domanda, anche perché il nostro obiettivo è un altro, ovvero demistificare l’idea che rispettare Data Integrity sia difficile. Anche se la cGMP può essere considerata un insieme di linee guida a sé stanti, è meglio comprendere bene il significato dell’acronimo. Infatti, Data Integrity è semplicemente un sottoprodotto, un sottoinsieme delle cGMP. Ma garantire l’integrità dei dati è altrettanto importante che seguire le cGMP, se non di più, specialmente al giorno d’oggi quando tutti i processi e tutte le applicazioni diventano Data Driven.

E perché è stato necessario questo sottoprodotto?
L’intero concetto di cGMP ha avuto origine da un evento di mancanza dei dati oggettivi su un lotto di compresse contaminate e la conseguente incapacità di ritirarlo dal mercato, prima che causasse centinaia di morti nel 1941. Al giorno d’oggi le agenzie regolatorie hanno diversi strumenti per prevenire un tale disastro: ispezioni casuali, avvertimenti ufficiali e sequestri di medicinali. Ma lo strumento più efficace in assoluto è, naturalmente, fornire le linee guida sull’integrità dei dati, perché sono misure preventive anziché reattive.
E dato che il mondo cambia continuamente, cambiano anche le modalità di generare, gestire e utilizzare i dati. Cambiano anche la consapevolezza e le priorità dei diversi dati e processi. Per cui, anche se le GMP rimangono un documento fondamentale, diventa inevitabile sviluppare una guida dedicata ai dati, una guida chiara e specifica che permette di focalizzarsi su ciò che rappresenta sempre di più il farmaco somministrato al paziente.
DATA INTEGRITY E SICUREZZA
 Prendiamo ad esempio le General Data Protection Regulation (GDPR), una normativa entrata in vigore pressoché nello stesso periodo del Data Integrity. La sicurezza dei dati degli utenti è diventata più critica nell’era di internet e semplicemente l’integrità e la sicurezza dei dati vanno di pari passo.
Prendiamo ad esempio le General Data Protection Regulation (GDPR), una normativa entrata in vigore pressoché nello stesso periodo del Data Integrity. La sicurezza dei dati degli utenti è diventata più critica nell’era di internet e semplicemente l’integrità e la sicurezza dei dati vanno di pari passo.
L’integrità dei dati, come definita nel documento FDA, è “la completezza, la coerenza e l’accuratezza dei dati”, e per ottenere l’integrità, i dati dovrebbero seguire i principi ALCOA+, dei quali abbiamo parlato in maniera approfondita in un precedente articolo, di cui riportiamo un breve estratto:
- Il personale deve essere formato per prevenire e rilevare problemi di integrità dei dati.
- Ogni problema di qualità rilevato deve essere gestito formalmente.
- Solo il personale autorizzato deve avere l’accesso necessario per modificare i record.
- Ogni utente dovrebbe avere le proprie credenziali di accesso, anziché condivise.
- È fortemente consigliato l’uso di firme elettroniche invece di quelle manoscritte (cartacee).
PERCHÉ ESSERE SEMPRE ALLINEATI E CONFORMI ALLE NORMATIVE?
Rispettare le cGMP, e più in specifico, garantire Data Integrity, significa dedicare molte risorse alla propria operatività. Devono essere mantenuti sistemi e procedure di qualità appropriati, i dipendenti devono essere qualificati e costantemente formati, i laboratori di analisi devono essere affidabili e apparecchiature sempre calibrate. Ma tutte queste caratteristiche costose descrivono non solo le aziende intenzionate a raggiungere il successo. Sono elementi obbligatori anche per qualunque azienda che desidera rimanere sul mercato. 
È chiaro per tutti che esiste una relazione diretta tra l’integrità dei dati e la qualità del prodotto. Ma è altrettanto vero che esiste una relazione diretta tra l’integrità dei dati e i costi del prodotto, concetto importantissimo, a meno che l’azienda non detiene il brevetto del farmaco e non teme concorrenza.
La sfida, dunque, è garantire l’integrità dei dati con un investimento ben studiato e programmato e, soprattutto, accettabile.
Chiedendo di rispettare le linee guida, la FDA non sta facendo altro che aiutare le aziende di semplificarsi la vita. Paradossale, ma è così. Dopo tutto la parola “current” in cGMP cerca semplicemente di ricordare alle aziende che i loro sistemi devono essere sempre aggiornati alle ultime tecnologie.
Già, perché anche il disastro del 1941 era dovuto in parte ad un’obsolescenza tecnologica. Ed è ingenuo pensare che un evento simile non possa verificarsi oggi. È vero che le tecnologie hanno compiuto passi da gigante, ma anche la complessità e i rischi del mondo d’oggi non possono essere paragonati a quelli di cento anni fa. E le aziende che rimangono bloccate nel passato e non investono in tecnologie, rischiano di essere, giustamente, spazzate via.
COSA SIGNIFICA LA GUIDA DI FDA PER LA MIA AZIENDA?
Ci siamo dilungati anche troppo a discutere dell’importanza del Data Integrity. Era necessario farlo per arrivare ad una premessa importante: oggi l’integrità dei dati non può essere garantita se non attraverso moderni mezzi tecnologici.

Quali quindi sono le tecnologie e gli strumenti che possono essere impiegati nelle aziende, e più in specifico, nei laboratori di analisi e reparto di produzione? Trattandosi dell’integrità dei dati, naturalmente dobbiamo sfruttare tutte quelle nuove tecnologie che riguardano i dati: IoT, BigData, Cloud, BPM e piattaforme Low-Code, Analytics e IA.
Per entrare più nel merito ecco i principali sistemi che possono essere installati:
- LIMS (Laboratory Information Management System)
- LES (Laboratory Execution System)
- ELN (Electronic Laboratory Notebook)
- SDMS (Scientific Data Management System)
- QMS / DMS (Quality / Document Management System)
- MES / EBR
- …
È vero, alcuni di questi esistevano già 20 anni fa. Anzi, sicuramente alcuni sono già presenti nella vostra azienda. Ma la domanda è:
| i sistemi che abbiamo oggi sfruttano davvero le nuove tecnologie? Rispettano veramente le ultime linee guida su Data Integrity e current GMP? |
C’è da dire che non tutte le tecnologie elencate sono importanti nella stessa misura per DI. BigData, Analitics e IA vanno meglio per ottimizzare i processi e i costi, per guidare le scelte sull’operatività, meno quelle sulla sicurezza dei dati. La tecnologia che più da vantaggio è sicuramente l’IoT, perché permette di raccogliere i dati direttamente (senza intervento umano) dai dispositivi digitali. BPM e Cloud, a loro volta, permettono di sviluppare flussi estremamente articolati, complessi ed automatizzati che gestiscono questi dati ed evitano agli utenti di eseguire operazioni manuali, azzerando così i rischi relativi agli errori, perdita e manomissione dei dati.
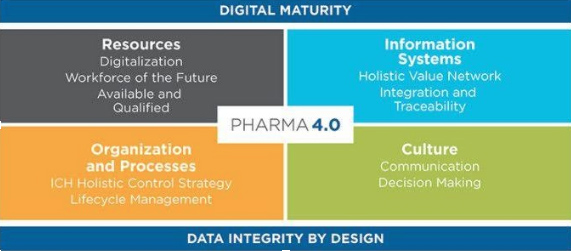
CONCLUSIONI
Il principale rischio per l’integrità dei dati è rappresentato degli utenti stessi. Essendo esseri umani, le persone tendono a non rispettare le procedure, a commettere errori, a dimenticare le scadenze, a sottovalutare i rischi e, purtroppo, a modificare intenzionalmente i dati.
Tra tutti i 9 termini dell’acronimo ALCOA+ quello che forse è il più importante è ACCURATO, perché può essere applicato agli altri 8. Solo sistemi automatici possono eseguire sempre in maniera accurata tutte le azioni definite per garantire l’integrità del dato.
È facile garantire l’integrità dei dati se questa viene delegata ai sistemi digitali di ultima generazione. Certo, potrebbe essere meno facile l’adozione di tali sistemi, ma sicuramente non a causa dei sistemi. La resistenza delle persone al cambiamento, il gap culturale e di competenze digitali sono uno degli ostacoli più grandi all’innovazione tecnologica. I nostri progetti consistono, in gran parte, nel lavorare con le persone, più che con i sistemi digitali, nell’accompagnare le case farmaceutiche nella loro crescita digitale. Abbiamo dedicato diversi dei nostri articoli a questo tema e sicuramente lo affronteremo ancora.
Visita il sito di Ympronta per saperne di più